Wie nehmen Zellen mechanische Kräfte wahr – und wie reagieren sie darauf? Diese Frage ist zentral für das Verständnis von Gewebeentwicklung, Homöostase und zahlreicher Erkrankungen. Drei Forschungsteams aus Deutschland, Frankreich und den USA haben gemeinsam ein innovatives Material entwickelt, mit dem sich mechanische Kräfte gezielt und schonend auf einzelne Zellkontakte ausüben und zugleich präzise vermessen lassen. Die Ergebnisse wurden in der renommierten Fachzeitschrift Advanced Science veröffentlicht.
Im Mittelpunkt der Arbeit steht eine neuartige lichtaktivierbare Hydrogel-Oberfläche, auf der Zellen kultiviert werden können. Prof. Aránzazu del Campo, Wissenschaftliche Geschäftsführerin am INM – Leibniz-Institut für Neue Materialien in Saarbrücken, erklärt: „Mithilfe von Licht lassen sich winzige molekulare Motoren in diesem Material aktivieren, die mechanische Zugkräfte auf die Andockstellen der Zelle – die sogenannten Integrine – ausüben. Diese spielen eine Schlüsselrolle bei der mechanischen Wahrnehmung durch die Zelle.“
Wird das System beleuchtet, beginnen sich die molekularen Motoren zu drehen und übertragen über flexible Polymerketten eine definierte Zugkraft auf die Zelloberfläche – präzise, lokal begrenzt und ohne die Zelle zu schädigen. Gleichzeitig ermöglichen fluoreszierende Partikel im Gel, deren Position sich durch die von den Zellen ausgeübten Kräfte verändert, eine Quantifizierung der Kräfte, mit denen die Zelle selbst auf ihre Umgebung einwirkt.
„Mit dieser Methode konnten wir in Echtzeit beobachten, wie Zellen auf mechanische Reize reagieren“, erläutert Dr. Rinku Kumar, Wissenschaftler in der Forschungsabteilung Dynamische Biomaterialien des INM und Erstautor der Studie. „Besonders bemerkenswert ist, dass diese Effekte reversibel sind: Wird das Licht ausgeschaltet, verschwindet die äußere Zugkraft und wir können verfolgen, wie die Zellen in ihren ursprünglichen Zustand zurückkehren.“
Die Studie liefert damit neue Einblicke in die Mechanotransduktion, also in die Umwandlung mechanischer Reize in biologische Signale. Die entwickelte Technologie eröffnet neue Möglichkeiten, die Rolle mechanischer Kräfte in krankem Gewebe, etwa bei der Wundheilung oder bei Krebserkrankungen, oder bei der Entwicklung neuer biomaterialbasierter Therapien gezielt zu untersuchen.
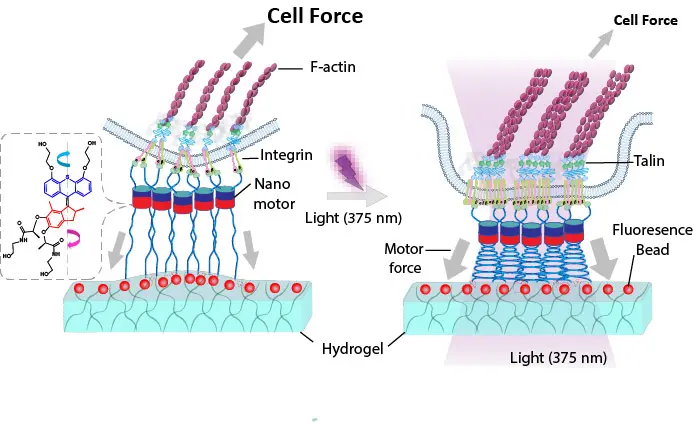
Die Abbildung zeigt ein lichtgesteuertes Hydrogel, das Zellen gezielt Kräfte zuführt. Winzige molekulare Motoren sind über flexible Ketten mit der Zelloberfläche verbunden und ziehen, wenn sie durch Licht aktiviert werden, an den Zellkontakten. Leuchtende Partikel im Gel zeigen dabei, wie stark die Zellen ziehen, während sie gleichzeitig ihr inneres Gerüst aus Aktin und wichtigen Andockproteine wie Talin anpassen.
Publikation:
Der Artikel “An Opto-Actuated Hydrogel for Cell Mechanoactuation and Real-Time Force Monitoring” von Rinku Kumar, Marc A. Fernandez-Yague, Adrien Bessaguet, Hosoowi Lee, Nicolas Giuseppone, Andrés J. García und Aránzazu del Campo wurde am 4. Januar 2026 in Advanced Science veröffentlicht

